Cara Mudah Menggam bar Struktur Lewis Suatu Molekul
 Judul
tulisan ini adalah cara mudah menggambarkan struktur Lewis suatu
molekul, meskipun cara termudahnya hanyalah dengan banyak berlatih
dengan mengikuti urutan yang disarankan seperti yang ada pada tulisan
ini. Dengan langkah-langkah seperti yang tertulis tentu akan menjadi
lebih mudah menggambarkan struktur Lewis suatu molekul.
Judul
tulisan ini adalah cara mudah menggambarkan struktur Lewis suatu
molekul, meskipun cara termudahnya hanyalah dengan banyak berlatih
dengan mengikuti urutan yang disarankan seperti yang ada pada tulisan
ini. Dengan langkah-langkah seperti yang tertulis tentu akan menjadi
lebih mudah menggambarkan struktur Lewis suatu molekul.
Struktur Lewis dari suatu molekul adalah
cara menggambarkan bagaimana atom-atom berikatan membentuk molekul
dengan menggunakan penanda seperti noktah atau tanda x untuk mewakili
elektron yang terlibat dalam pembentukan molekul. Elektron yang terlibat
ini biasanya hanya elektron valensi (elektron yang berada di kulit
terluar).
Untuk
penjelasan lebih joss dan lebih mudah dan update terbaru tentang
Struktur Lewis, Hibridisasi, Bentuk Molekul, dan lain-lain silakan klik
pranala ini.Prinsip dalam menggambarkan struktur Lewis suatu molekul adalah mengupayakan agar elektron di sekitar atom dalam setiap molekul berjumlah delapan atau mengikuti aturan oktet. Dengan memiliki elektron sebanyak 8 setiap atom diharapkan menjadi stabil dengan membentuk ikatan.
Untuk itu sebelum dapat menggambar struktur Lewis suatu molekul harus memahami bagaimana menentukan konfigurasi elektron setiap atom. Biasanya dalam soal-soal disertai dengan data nomor atom setiap unsur yang akan digunakan, tujuannya tidak lain agar dapat menuliskan konfigurasi elektronnya sehingga elektron valensinya juga dapat diketahui.
CARA MENGGAMBAR STRUKTUR LEWIS UNTUK MOLEKUL YANG TIDAK MENGANDUNG ATOM BERMUATAN
- Hitung jumlah semua elektron valensi untuk setiap atom dalam molekul (selanjutnya dalam tulisan ini disebut total elektron valensi).
- Hitung jumlah elektron valensi setiap atom dalam molekul jika atom-atom itu sesuai aturan oktet (selanjutnya dalam tulisan ini disebut total elektron oktet). Aturan oktet menyatakan bahwa semua atom harus memiliki delapan elektron valensi (kecuali untuk hidrogen, yang cukup dua saja, dan boron dengan enam elektron).
- Hitung selisih jumlah elektron yang sesuai aturan oktet dengan jumlah elektron valensi nyatanya (hasil pada langkah #2 dikurangi hasil pada langkah #1). Selisih ini akan sama dengan jumlah elektron yang digunakan berikatan dalam molekul. (selanjutnya dalam tulisan ini disebut total elektron berikatan)
- Bagilah jumlah elektron berikatan dengan angka dua: Ingat, karena setiap ikatan memiliki dua elektron, jumlah elektron yang digunakan bersama dua atom yang berikatan. Hasil bagi ini merupakan jumlah ikatan yang akan digunakan dalam molekul. (selanjutnya dalam tulisan ini disebut jumlah ikatan)
- Gambarkan susunan atom untuk molekul dengan jumlah ikatan yang diperoleh pada langkah #4 di atas: Beberapa aturan berguna untuk diingat adalah ini:
-
- Hidrogen dan halogen: berikatan sekali.
- Golongan oksigen: berikatan dua kali.
- Golongan nitrogen: berikatan tiga kali. Begitu pula boron.
- Golongan karbon: berikatan empat kali.
Sebaiknya ikatan-ikatan yang dipasang
antaratom adalah ikatan tunggal terlebih dahulu, dan kemudian
menambahkan beberapa ikatan (jika diperlukan) sampai aturan diatas
diikuti.
Catatan:
Unsur yang lebih elektroprositif atau kurang elektronegatif (dalam
tabel periodik unsur letaknya di sebelah kiri (kecuali H) atau sebelah
bawah atau jari-jari atomnya lebih besar) lebih mungkin sebagai atom
pusat. Perkecualian pada Cl2O, O yang berperan sebagai atom
pusat. H tidak akan pernah sebagai atom pusat. Atom pusat ketika
membentuk ikatan harus mengikuti aturan oktet, kecuali Be hanya 4
elektron ikatan dan B hanya 6 elektron ikatan.
- Tentukan jumlah pasangan elektron bebas (tak berikatan). Caranya hitung jumlah elektron valensi – jumlah elektron yang digunakan untuk berikatan
atau dengan cara kurangi hasil hitung langkah #1 dengan hasil hitung pada langkah # 3.
Tata semuanya di sekitar atom sampai semua
memenuhi aturan oktet: Ingat, SEMUA unsur agar di sekitarnya ada
delapan elektron, secara total (KECUALI hidrogen). Hidrogen cukup dua
elektron. Oh ya untuk unsur yang terletak pada periode 3 (misalnya S
belerang) sering jumlah elektron disekitarnya lebih dari delapan, dengan
pertimbangan muatan formalnya nol akan lebih disukai.
- Menguji keberadaan muatan formal, (muatan formal ini adalah muatan semu, hasil perbandingan antara elektron valensi setiap atom dengan jumlah elektron yang dimiliki ketika membentuk ikatan dengan atom yang lain).
Muatan formal tiap atom = elektron valensi atom – jumlah ikatan dengan atom lain – jumlah elektron bebas (tidak digunakan berikatan) yg dimiliki.
Contoh penerapan untuk molekul CH2O- Total elektron valensi adalah 12.
2 elektron valensi H (2 atom H × 1 elektron/atom = 2 elektron)
4 elektron valensi C (1 atom C × 4 elektron/atom) = 4 elektron)
6 elektron valensi O (1 atom O × 6 elektron/atom) = 6 elektron)
Jumlah elektron valensi pada CH2O = 2+4+6 = 12 elektron
4 elektron valensi C (1 atom C × 4 elektron/atom) = 4 elektron)
6 elektron valensi O (1 atom O × 6 elektron/atom) = 6 elektron)
Jumlah elektron valensi pada CH2O = 2+4+6 = 12 elektron
- Total elektron oktet semua atom dalam CH2O = 20, diperoleh dari:
(2 atom H × 2 elektron) + 1atom C × 8 elektron) + (1 atom O × 8 elektron) = 4 + 8 + 8 = 20 elektron.
- Total elektron berikatan sama dengan total elektron oktet dikurangi total elektron valensi, atau 20 – 12 = 8.
- Jumlah ikatan = total elektron berikatan dibagi dua, karena ada dua elektron per ikatan. Akibatnya, di CH2O, jumlah ikatannya = 4. (Karena 8/2 adalah 4).
- Penggambaran struktur Lewis, tuliskan atom C di tengah dan atom
lainnya (2 atom H dan 1 atom O) berada di sekeliling atom C. Cantumkan
elektron berikatan (masing-masing 2 elektron setiap ikatan) di antara
atom pusat (C) dengan atom yang ada disekitarnya, antara atom C dan O
yang paling mungkin memiliki ikatan rangkap 2 (double bond). Lakukan
hingga semua (dalam hal ini 8 elektron berikatan terpakai).


- Jumlah pasangan elektron bebas = total elektron valensi (dari # 1) dikurangi total elektron berikatan (dari # 3), yang dalam contoh ini sama dengan 12 – 8, atau 4. Melihat struktur CH2O, dapat dilihat bahwa karbon sudah memiliki delapan elektron di sekitarnya. Oksigen, hanya memiliki empat elektron di sekitarnya (lihat gambar pada nomor 5 di atas). Untuk melengkapi gambar, masing-masing oksigen harus memiliki dua set pasangan elektron bebas, Tambahkan pasangan elektron bebas pada atom O sehingga aturan oktet terpenuhi.seperti dalam struktur Lewis berikut:
- Menguji ada tidaknya muatan formal tiap atom.
Contoh penerapan untuk molekul H2CO3Jadi benar bahwa molekul CH2O ini tidak bermuatan alias netral.
- Muatan formal C = 4 (e.valensi) – 4 (jumlah ikatan) – 0 (jumlah elektron bebas) = 0
- Muatan formal H = 1 – 1 – 0 = 0
- Muatan formal O = 6 – 2 – 4 = 0
- Total elektron valensi adalah 24.
2 elektron valensi H (2 atom H × 1 elektron/atom = 2 elektron)
4 elektron valensi C (1 atom C × 4 elektron/atom) = 4 elektron)
18 elektron valensi O (3 atom O × 6 elektron/atom) = 18 elektron)
Total elektron valensi pada H2CO3 = 24 elektron
4 elektron valensi C (1 atom C × 4 elektron/atom) = 4 elektron)
18 elektron valensi O (3 atom O × 6 elektron/atom) = 18 elektron)
Total elektron valensi pada H2CO3 = 24 elektron
- Total elektron oktet semua atom dalam H2CO3 = 36, diperoleh dari:
(2 atom H × 2 elektron) + 1atom C × 8 elektron) + (3 atom O × 8 elektron) = 4 + 8 + 24 = 36 elektron.
- Total elektron berikatan sama dengan total elektron oktet dikurangi total elektron valensi, atau 36 – 24 = 12.
- Jumlah ikatan = total elektron berikatan dibagi dua, karena ada dua elektron per ikatan. Akibatnya, di H2CO3, jumlah ikatannya = 6. (Karena 12/2 adalah 6).
- Penggambaran struktur Lewis, tuliskan atom C di tengah dan atom lainnya (2 atom H dan 3 atom O) berada di sekeliling atom C. Cantumkan elektron berikatan (masing-masing 2 elektron setiap ikatan) di antara atom pusat (C) dengan atom yang ada disekitarnya, perhatikan antara atom C dan O ada yang memungkinkan memiliki ikatan rangkap 2 (ikatan dobel). Lakukan hingga semua elektron berikatan terpakai (dalam hal ini 12 elektron berikatan terpakai atau dengan sistem garis, 6 garis).
- Jumlah pasangan elektron bebas = total elektron valensi (dari # 1) dikurangi total elektron berikatan (dari # 3), yang dalam contoh ini sama dengan 24 – 12, atau 12. Melihat struktur H2CO3, dapat dilihat bahwa karbon sudah memiliki delapan elektron (empat ikatan) di sekitarnya. Setiap oksigen akan mendapat bagian masing-masing 2 pasang elektron bebas untuk memenuhi aturan oktet, untuk atom H sudah memenuhi aturan duplet. H2CO3 mempunyai struktur Lewis:
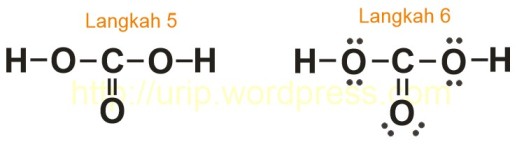
- Menguji ada tidaknya muatan formal tiap atom.
- Muatan formal C = 4 (e.valensi) – 4 (jumlah ikatan) – 0 (jumlah elektron bebas) = 0
- Muatan formal H = 1 – 1 – 0 = 0 —–pada moleluk ini kedua atom H muatan formalnya sama.
- Muatan formal O (yang berikatan rangkap dengan C) = 6 – 2 – 4 = 0
- Muatan formal O (yang berikatan dengan C dan H) = 6 – 2 – 4 = 0
CARA MENGGAMBAR STRUKTUR LEWIS UNTUK MOLEKUL YANG MENGANDUNG SATU ATAU LEBIH ATOM BERMUATAN
Cara ini pada dasarnya adalah sama dengan cara di atas, kecuali ada beberapa aturan tambahan. Perubahan prosedur di atas diuraikan dengan huruf berwarna merah.
- Hitung jumlah semua elektron valensi untuk setiap atom dalam molekul (selanjutnya dalam tulisan ini disebut total elektron valensi). Untuk anion poliatomik, tambahkan muatan ion (jumlah elektron yang diterima) dengan jumlah elektron valensi.. Untuk kation poliatomik, kurangi muatan ion (jumlah elektron yang dilepas) dari jumlah elektron valensi.
- Hitung jumlah elektron valensi setiap atom dalam molekul jika atom-atom itu sesuai aturan oktet (selanjutnya dalam tulisan ini disebut total elektron oktet). Aturan oktet menyatakan bahwa semua atom harus memiliki delapan elektron valensi (kecuali untuk hidrogen, yang cukup dua saja, dan boron dengan enam elektron).
- Hitung selisih jumlah elektron yang sesuai aturan oktet dengan jumlah elektron valensi nyatanya (hasil pada langkah #2 dikurangi hasil pada langkah #1). Selisih ini akan sama dengan jumlah elektron yang digunakan berikatan dalam molekul (selanjutnya dalam tulisan ini disebut total elektron berikatan).
- Bagilah jumlah elektron berikatan dengan angka dua: Ingat, karena setiap ikatan memiliki dua elektron, jumlah elektron yang digunakan bersama dua atom yang berikatan. Hasil bagi ini merupakan jumlah ikatan yang akan digunakan dalam molekul (selanjutnya dalam tulisan ini disebut jumlah ikatan).
- Gambarkan susunan atom untuk molekul dengan jumlah ikatan yang diperoleh pada langkah #4 di atas: Beberapa aturan berguna untuk diingat adalah ini:
-
- Hidrogen dan halogen: dapat berikatan sekali.
- Golongan Oksigen dapat berikatan satu, dua, atau tiga kali.
- Golongan Nitrogen dapat berikatan dua, tiga, atau empat kali
- Golongan Boron biasanya dapat berikatan empat kali.
- Golongan Karbon dapat berikatan empat kali.
Sebaiknya ikatan-ikatan yang dipasang
antaratom adalah ikatan tunggal terlebih dahulu, dan kemudian
menambahkan beberapa ikatan (jika diperlukan) sampai aturan diatas
diikuti. Catatan
unsur yang lebih elektroprositif atau kurang elektronegatif (dalam tabel
periodik unsur letaknya di sebelah kiri (kecuali H) atau sebelah bawah
atau jari-jari atomnya lebih besar) lebih mungkin sebagai atom pusat.
- Tentukan jumlah pasangan elektron bebas (tak berikatan). Caranya hitung jumlah elektron valensi – jumlah elektron yang digunakan untuk berikatan
atau dengan cara kurangi hasil hitung langkah #1 dengan hasil hitung pada langkah # 3.
Tata semuanya di sekitar atom sampai semua
memenuhi aturan oktet: Ingat, SEMUA unsur agar di sekitarnya ada
delapan elektron, secara total (KECUALI hidrogen). Hidrogen cukup dua
elektron. Catatan unsur yang dalam tabel periodik unsur letaknya di sebelah kiri (kecuali H) lebih mungkin sebagai atom pusat.
- Untuk menentukan apakah atom memiliki muatan, bandingkan jumlah elektron setiap atom dengan jumlah elektron valensi normalnya. Langkah ini sama dengan kita menguji keberadaan muatan formal setiap atom dalam molekul, sehingga pada bagian akhir kita akan tahu molekul itu bermuatan atau tidak, kalau bermuatan kita jadi tahu atom mana yang menyumbang muatan tersebut.
Untuk
tujuan ini (tinjauan tiap atom), setiap ikatan dihitung hanya satu
elektron dan setiap pasangan elektron bebas dihitung dua elektron.
Jika jumlah elektron yang dimiliki atom lebih dari jumlah elektron valensi normal, maka atom memiliki muatan negatif. Jika jumlahnya kurang dari jumlah elektron valensi normal, maka atom bermuatan positif. Jika itu sama dengan keadaan normal, maka atom tidak bermuatan.
Contoh penerapan untuk molekul CO32-- Total elektron valensi adalah 24.
4 elektron valensi C (1 atom C × 4 elektron/atom) = 4 elektron)
18 elektron valensi O (3 atom O × 6 elektron/atom) = 18 elektron)
2 elektron yang diterima (karena ion bermuatan 2-)
Jumlah elektron valensi pada CO32- dianggap = 24 elektron
18 elektron valensi O (3 atom O × 6 elektron/atom) = 18 elektron)
2 elektron yang diterima (karena ion bermuatan 2-)
Jumlah elektron valensi pada CO32- dianggap = 24 elektron
- Total elektron oktet semua atom dalam CO32- = 32, diperoleh dari:
(1 atom C × 8 elektron) + (3 atom O × 8 elektron) = 8 + 24 = 32 elektron.
- Total elektron berikatan = total elektron oktet dikurangi total elektron valensi, atau 32 – 24 = 8.
- Jumlah ikatan = total elektron berikatan dibagi dua, karena ada dua elektron per ikatan. Akibatnya, di CO32-, jumlah ikatannya = 4. (Karena 8/2 adalah 4).
- Penggambaran struktur Lewis, tuliskan atom C di tengah dan 3 atom O berada di sekeliling atom C. Cantumkan elektron berikatan (masing-masing 2 elektron setiap ikatan atau langsung dengan menuliskan garis ikatan (perikatan 2 elektron)) di antara atom pusat (C) dengan atom O yang ada disekitarnya, perhatikan antara atom C dan O ada yang memungkinkan memiliki ikatan rangkap 2 (ikatan dobel). Lakukan hingga semua elektron berikatan terpakai (dalam hal ini 8 elektron berikatan terpakai atau dengan sistem garis, 4 garis).
- Jumlah pasangan elektron bebas = total elektron valensi (dari # 1) dikurangi total elektron berikatan (dari # 3), yang dalam contoh ini sama dengan 24 – 8, atau 16. Melihat struktur CO32-, dapat dilihat bahwa karbon sudah memiliki delapan elektron (4 ikatan) di sekitarnya. Pada O yang berikatan rangkap dengan C hanya perlu 2 pasangan elektron bebas hingga memenuhi aturan oktet, dua O lainnya masing-masing perlu 3 pasang elektron bebas untuk memenuhi aturan oktet karena antara O dan C hanya berikatan tunggal (yang sama dengan punya dua elektron)
- Menentukan atom manakah yang kemungkinan bermuatan adalah dengan membandingkan elektron yang dimiliki dengan elektron valensi normalnya. Dalam hal ini O yang ada di kiri dan kanan atom C elektronnya berlebih satu dari jumlah elektron valensi yang seharusnya. Seharusnya hanya punya 6 tetapi pada bagian tersebut O punya 7 elektron (6 + 1 elektron diambil dari elektron ikatan antara dirinya dengan atom C).

Video-video tentang penjelasan struktur lewis dapat ditonton atau diunduh dari sini. Pada link tersebut terdapat lebih dari 70 struktur Lewis.
Pranala lain untuk video cara menggambar struktur Lewis ada di web thegeoexchange.org.
Selamat belajar dan wassalam.



















